研究
基礎研究
病態解明
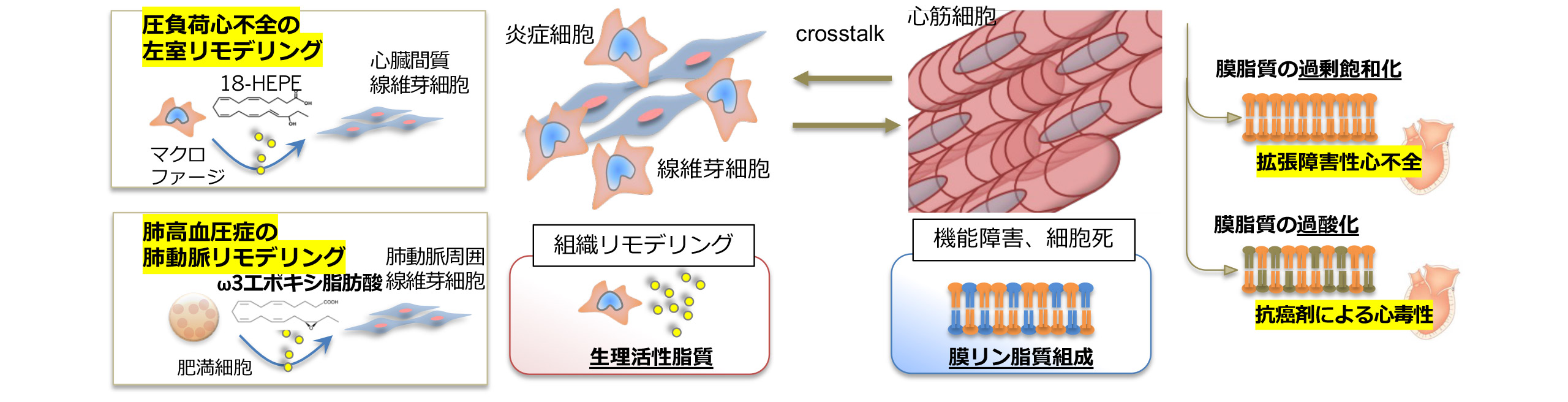
脂質代謝に着目した心血管疾患発症機序の解明
心血管系疾患の発症や進展に関連する脂質について研究をしています。脂質のバランス変化がどのように心筋細胞の機能や細胞死に影響を与えているかを明らかにし(Kitakata H, et al. J Mol Cell Cardiol. 2021)、炎症細胞や線維芽細胞が作り出す新しい脂質代謝物を探索し臨床応用を目指しています(Endo J, et al. J Exp Med. 2014, Moriyama H. et al. Nat Commun. 2022)。
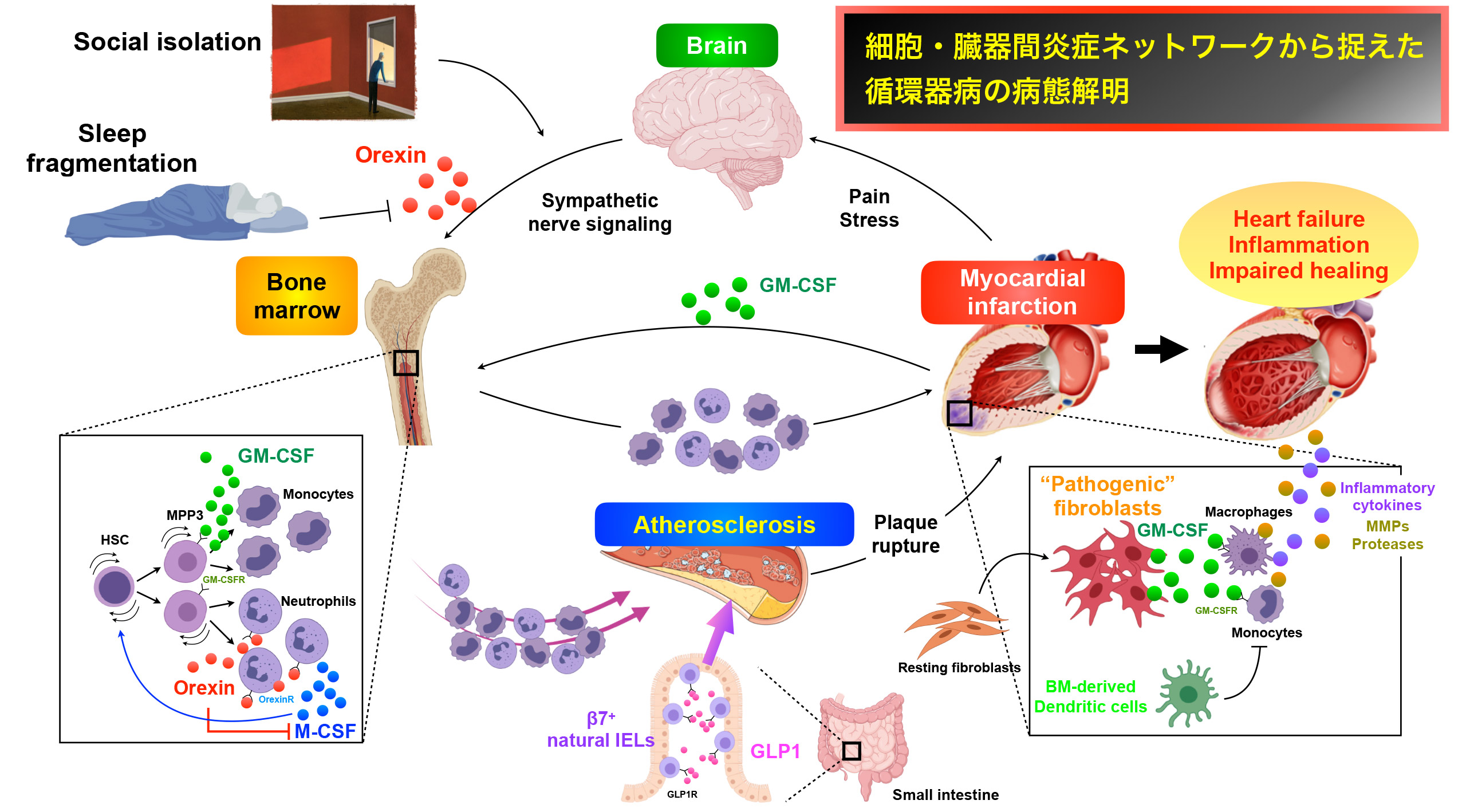
細胞・臓器間炎症ネットワークから捉えた循環器病の病態解明
一つの個体において病態が形成する”Systemic Multi-organ Inflammatory Network”に主眼をおき、疾患の主臓器である心臓や血管のみならず、骨髄、脾臓、脳、小腸など各種臓器を細胞・分子レベルで解析することで様々な角度から疾患を捉え、その仲介役として骨髄由来の炎症/免疫細胞に着目しながら、より新しい視点で疾患の病態解明を試みる研究を行っています(Anzai et al. Circulation 2012, Anzai et al. J Exp Med 2017, Anzai et al. J Exp Med 2019 etc)。
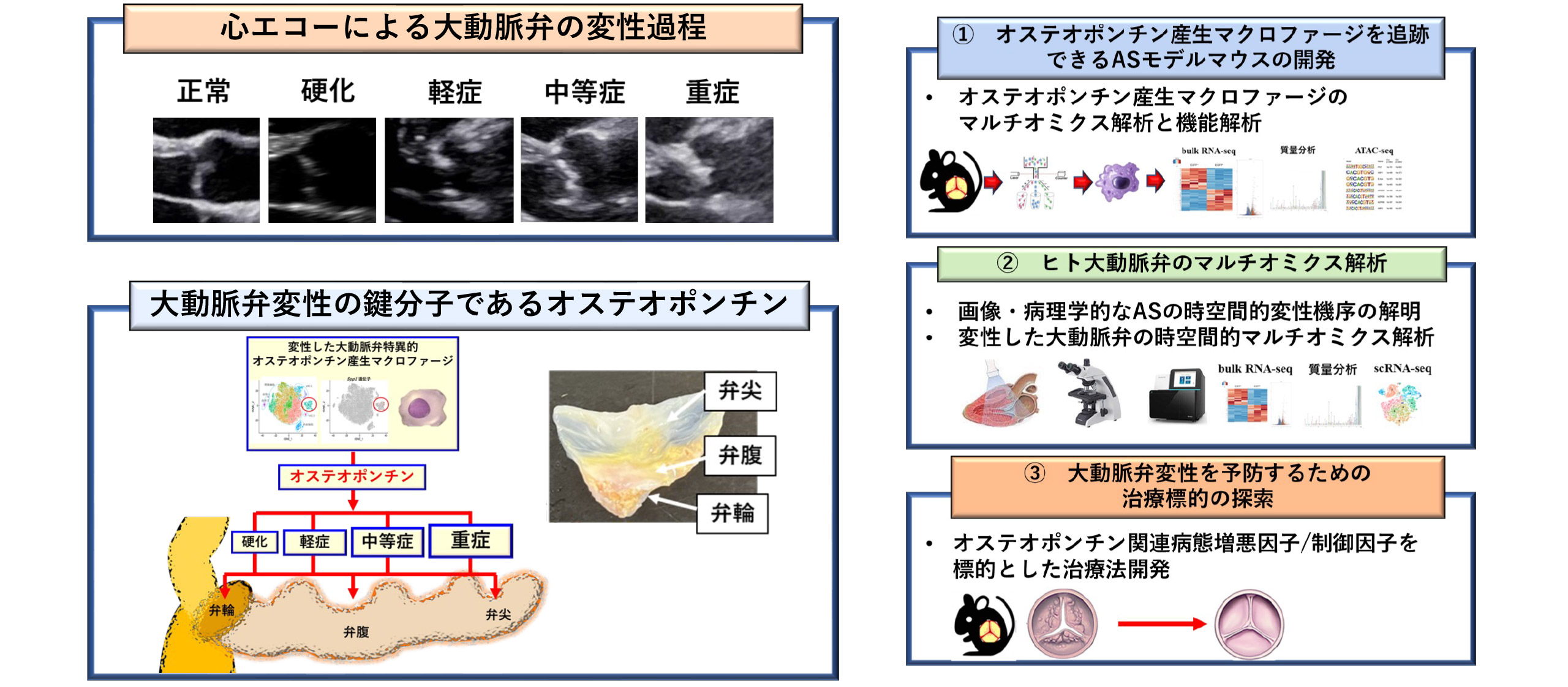
弁膜症の時空間的病態解明と治療標的の探索
弁膜症の一つである大動脈弁狭窄症(AS)は、弁置換術以外に根治的治療法がなく、弁変性を抑制できる有効な治療標的は見つかっていません。その理由として、既存の研究は極度に変性した弁を解析しているため、軽症や中等症の弁の変性過程に関して不明な点が多いことが一因として挙げられます。近年、大動脈弁のマイクロアレイデータを統合した重みづけ遺伝子共発現ネットワーク解析により、大動脈弁変性の鍵分子としてオステオポンチンが同定されました。オステオポンチンは線維化・炎症を惹起する炎症性蛋白であり、ASの重要な治療標的である可能性があります(Shirakawa K et al., Front Immunol 2023, Shirakawa K et al., Circulation 2018, Shirakawa K et al., JCI 2016)。当教室では弁変性過程における免疫学的な病態解明を目的とした研究を行っています。